CHB 환자에서 엔테카비어의 우수한 효능 및 낮은 저항, 관련 인자들
Viral load and alanine aminotransferase correlate with serologic response
in chronic hepatitis B patients treated with entecavir.

BMS 바라크루드
배경 및 목적
비록 엔테카비어가 만성 B 형 간염(CHB) 치료에 우수한 효능과 낮은 저항을 가지고 있지만, 이와 관련된 인자들은 알려지지 않았다.
방법
이 연구는 후향적 다기관 연구로 1 년 이상 엔테카비어로 치료를 받은 간염 Be항원(HBeAg) 양성 환자(연령중앙값 39.4세, 남성 69.4%) 248명을 대상으로 하였으며, 15.7%가 간경화를 가지고 있었다. 1차 종말점은 HBeAg 소실 및/또는 혈청전환이었다.
결과
기저시점의 알라닌 아미노전이효소(ALT) 및 B형 간염 바이러스(HBV) DNA의 중앙값은 각각 201 U/L (27-2415 U/L), 7.6 log10 IU/mL (2.2–13.18)이었다. 치료기간 중앙값은 25.3개월(12-69.6)이었다. ALT 정상화율은 1년, 2년, 3년차에 각각 83.1%, 87.9% 및 94.9%였다. 1년, 2년, 3년차의 HBeAg 소실 누적률은 각각 20.3%, 38.0%, 48.9%이었다. HBV-DNA 탐지불능률은 1년, 2년, 3년차에 각각 52.1%, 78.9%, 82.5%이었다. 콕스비례위험 모델을 사용한 다변량 분석 결과 ALT 기저치가 정상 상한치보다 5배 높았고, 바이러스 부하는 HBeAg 소실과 관련된 독립인자였다.
(위험비: 1.81과 0.812, 95% CI: 1.062-3.085 및 0.7-0.942).
결론
3 년간 엔테카비어 치료는 HBeAg 양성 CHB 환자에서 우수한 생화학 및 바이러스 반응을 달성하였지만, HBeAg 소실 및/또는 혈청전환에 대해서는 보통의 효과를 보였다. 또한, 기저 혈청 ALT 및 HBV-DNA 수치는 우수한 치료 반응과 관련된 독립인자이다.
서론
전세계 3억5천만명이 B형 간염 바이러스(Hepatitis B virus, HBV) 감염에 걸렸으며, 이는 세계 사망률의 10번째 원인이다. 매년 6십만건의 조기 사망에 이르는 HBV 관련 합병증에는 간경화, 간부전(hepatic decompensation) 및 간세포암(hepatocellular carcinoma, HCC)이 포함된다. 보편적인 B 형 간염 예방 접종 프로그램 도입 이후 HBV 감염 빈도는 현저하게 감소했지만, 만성 B형 간염 (CHB)은 여전히 전세계적으로 건강에 상당한 부담이 되고 있다.
인터페론(INF) 또는 nucleos(t)ide 유사체 치료는 CHB 환자의 간염과 간 합병증을 감소시킨다. 지금까지 두개의 면역조절제(기존 INF와 pegylated INF [PEG-INF])와 5개의 nucleoside/nucleotide 유사체가 널리 사용되고 있다. 이런 약제 중에서 라미부딘은 CHB 치료를 위해 승인된 최초의 경구용 nucleoside 유사체이다. 국민건강보험국에 의해 조직되어 2003년부터 대만에서 진행된 CHB 치료 프로그램이 있다. 현재 대만에서 라미부딘, 텔비부딘(telbivudine) 또는 엔테카비어(entecavir)와 같은 경구용 제제들은 HBeAg 양성 또는 음성 CHB 환자에서 3년까지 급여를 받을 수 있으며, 간경화 환자에서는 무기한 보험이 된다. 엔테카비어는 HBeAg 양성 및 음성 CHB 환자 모두에서 그 효과가 입증되었다. 라미부딘과 비교하여 엔테카비어는 치료 48 주 후 혈청 HBV-DNA 탐지불능, HBeAg-양성 CHB 환자의 ALT 정상화 및 조직학적 개선 빈도가 더 높게 나타났다. 그러나 HBeAg 혈청전환율은 유사하였다. 높은 항바이러스 역가(antiviral potency)와 약제내성에 대한 유전적 장벽 때문에 엔테카비어는 CHB 치료의 1차 치료제 중 하나로 추천되고 있다. 엔테카비어 장기 치료의 효능과 내성에 대한 실제 치료 데이터(real-world date)는 세계 여러 곳에서 사용할 수 있지만, 대만에서는 이러한 데이터가 여전히 부족하다. 대만에서 HBV 감염은 과다빈도풍토병이며, 엔테카비어 치료의 효능은 알려져 있지 않다. 따라서, 우리는 치료경험이 없는 HBeAg 양성 CHB 환자 248명에게 3년간 엔테카비어 치료 후 그 효능과 치료예후의 예측인자들을 평가하였다.
방법
환자. 이 연구는 ”대만에서 엔테카비어 치료의 후향적 연구: 만성 B형 간염 eAg 양성 치료 naive 연구”의 real-world 연구이다. 총 빌리루빈>2 mg/L, 또는 프로트롬빈 시간 연장(대조군과 비교하여 3초 초과)로 정의된 간 대상부전(liver decompensation) 환자는 제외시켰다. 2010년 7월부터 2005년 5월까지 6개 병원에서 1년 이상 엔테카비어(0.5 mg)를 투약한 248명의 치료 경험이 없는 HBeAg-양성 CHB 환자를 모집하였다. 모든 환자는 6 개월 이상 B형 간염 표면항원(HBsAg)의 병력을 가지고 있었으며, C형 또는 D형 간염 바이러스 동시 감염이나 간염의 어떤 원인도 갖고 있지 않았다. 선정 기준은 다음과 같았다: (i) 혈청 ALT 정상 상한치(ULN)의 5배를 초과하며, 3개월 이상 HBeAg 양성, (ii) 혈청 ALT 정상 상한치의 2배를 초과하며 HBV-DNA >20,000 IU/mL (또는 B형 간염 중심 항원 양성 조직 염색 양성[HBcAg])인 3개월 이상 HBeAg 양성, (ⅲ) 비장비대(splenomegaly) 또는 위식도 정맥류의 존재로 문맥 고혈압을 동반한 간경화, (IV) 치료를 받을 의향이 있지만 1-3의 기준을 충족시키지 못한 경우. 예를 들어, 혈청 ALT 수치가 정상 상한치의 2배를 초과하는 일부 환자들은 기꺼이 엔테카비어 치료를 받고자 하였다. 등록 환자들은 이 기준들 중 적어도 하나 이상을 충족해야만 한다. 환자가 1-3의 기준 중에서 한가지를 충족하면, 대만 국민건강보험국의 급여를 받을 수 있다. 그렇지 않다면, 환자 본인이 약값을 지불해야만 한다. 간경화는 조직학적 결과물 또는 결절 간 표면의 조립 에코결 초음파를 근거로 진단하였다. 다음과 같은 상황을 제외한 모든 환자들에게 지속적으로 엔테카비어 치료가 시행되었다. (i) 12개월 이상 강화 요법을 실시하여 HBeAg 소실 및/또는 혈청전환 유무; (ii) 추적관찰 실패; (iii) 환자가 치료 지속을 꺼리는 경우; (iv) 사망; (v) 임신. 엔테카비어 치료 기간은 치료를 처음 실시한 날짜부터 데이터 분석 시점까지로 하였다. 치료 반응은 다음의 기준에 따라서 정의하였다; (i) 생화학 반응: 혈청 ALT 수치가 정상; (ii) 혈청학적 반응: 항HBe 항체가 나타난 HBeAg 소실 및/또는 혈청전환; (iii) 바이러스 반응: 실시간 중합효소연쇄반응(real-time PCR) 분석으로 혈청 HBV-DNA 탐지불능.
혈청 A LT, HBV-DNA, HBeAg 및 항HBe 상태를 기저시점, 치료 3개월 및 6개월, 이후 매 6개월마다 측정하였다. HCC 역학감시를 위해 간초음파와 혈청 알파태아단백질(α-fetoprotein, AFP)을 매 6개월마다 시행하였다. 바이러스 돌파(virologic breakthrough)는 다음과 같이 정의하였다: (i) HBV-DNA가 탐지되는 환자에서 HBV-DNA 수치가 최하점에서 1 log10 IU/mL 이상 증가, 또는 (ii) 엔테카비어 치료 기간동안 HBV-DNA 탐지불능 환자에서 탐지 하한선 이상으로 HBV-DNA 증가. 최소한 1개월 간격으로 두가지 경우에 바이러스 돌파가 확인되었다. 아데포비어(adefovir) 추가 치료는 대만 국민건강보험국의 지침에 의해 3년간 급여를 받을 수 있다.
실험실 분석
ALT와 AST를 포함한 생화학적 데이터는 auto-analyzer로 측정하였다. 혈청 ALT의 cut-off는 40 IU/L이었다. HBeAg 및 항HBe 항체는 Abbott ARCHITECT i2000로 측정하였다. 6개 병원에서 HBV-DNA 역가는 다음의 4가지 방법으로 측정하였다. Cobas Taqman HBV 분석, in-house polymerase chain reaction, Abbott RealTime HBV 분석, Cobas Amplicor HBV 모니터 테스트.
윤리적 고려 사항
1975년 헬싱키 원칙에 따라 연구를 수행하였고, 각 기관에서 IRB의 승인을 받았으며, 서면 동의서를 모두 받았다.
통계학적 분석
HBeAg 소실 누적률은 Kaplan–Meier 법을 사용하여 분석하였고, 콕스비례위험모델을 사용하여 HBeAg 소실과 관련있는 인자들을 분석하였다. P 값이 0.05 미만인 경우 통계학적으로 유의성이 있는 것으로 고려하였다.
연구결과
환자 배치
본 연구에는 3개 의료기관 및 3개 지역 병원을 포함한 6개의 주요 병원에서 보상성 간 기능을 지닌 248명의 HBeAg 양성 CHB 환자가 참여하였다. 이 병원 중 4개는 대만 북부, 1개는 중부, 1개는 남부에 위치하였다.
기저시점의 인구학적 특성 및 임상적 특성
인구학적 특성 및 기저시점의 특성은 다음과 같다. 연구등록시 연령 중앙값은 39.4세(17.8세-77.5세)였다. 173명은 남자(69.8%), 75명은 여자(30.2%) 환자였다. 이 중 39명(15.7%)은 간경화증이 있었고, 9명(23.1%)은 간생검, 나머지는 초음파(76.9%)로 확진되었다. 그러나, 기저시점의 HBV-DNA 데이터는 248명 중 198명에서만 사용가능하였으며, 중앙값은 7.60 log10 IU/mL (2.2-13.18 log10 IU/mL)이었다. 태국의 급여지침으로 혈청 ALT가 정상 상한치의 5배 이상이면 HBV-DNA 데이터가 없이도 항바이러스제를 처방할 수 있다. 게다가, 기저시점에 HBV-DNA 데이터가 없는 소수의 환자들은 직접 약값을 지불하였다. 기저시점의 ALT 중앙값은 201 U/L (27-2415 U/L)이었다. 78명에서 HBV 유전형 데이터를 확인할 수 있었으며, 49명(62.8%)은 유전형 B, 28명(35.9%)은 C형, 1명(1.3%)은 B+C형이었다. 데이터 확인이 가능한 30례 중 9명의 환자가 PCM (precore mutant, 약을 먹어도 계속 증식함)으로 확인되었다. 기저의 core promoter 상태 확인이 가능했던 29명 중 12명(41.4%)에서 돌연변이형이 확인되었다. 기저시점의 정량적 HBsAg (qHBsAg) 수치를 56명에서 측정하였고, 중앙값은 7274.9 IU/mL (6.25-703 937 IU/mL). 선형회귀분석 결과 qHBsAg는 log HBV-DNA와 양의 상관관계가 있었다(Pearson's correlation coefficient=0.32, P=0.016). ALT 장애 정도에 따라 환자들을 분류했을 때 45명(18.2%)은 ALT가 정상 상한치의 2배 미만이고, 78명(31.%)는 정상 상한치의 2-5배, 67명(27.0%)은 5-10배, 58명(23.4%)은 10배 이상이었다. 치료기간 중앙값은 25.3개월(12.0-69.6개월)이었다. 분석시점에 19명(7.7%)이 치료를 중단하였다. 중단 이유는 HCC로 인한 사명 1명, 임신으로 인해 텔비부딘으로 교체 2명, 적절한 강화 치료(12개월 이상)로 HBeAg 소실 및/또는 혈청전환 10명이었다. 치료 종말점에 도달한 환자 중에서 8.7개월의 추적기간 동안(1-15개월) 임상적 재발 환자는 1명이었다(재발 정의: ALT가 정상 상한치 2배 이상이며 HBV-DNA 2000 IU/mL 초과). 그러므로, 내구성(durability)은 약 90%이다. 환자들을 매 3개월마다 추적조사하였다. 치료를 지속하는 환자들 중에서 4명은 바이러스 돌파(virologic breakthrough), 2명은 adherence가 나빴다. 그러므로, 바이러스 돌파율은 1.6%였다. 신장 사건이나 젖산 산증이 보고된 사례는 없었다.
바이러스 반응
혈청 HBV-DNA 탐지불능은 치료 1년, 2년, 3년차에 각각 52.11%(111/213), 78.91%/(101/128), 82.5%(33/40)에 도달하였다(표 1). 엔테카비어 치료 1년차에 32명(15%, 32/213)의 혈청 HBV-DNA가 60 IU/mL 미만이었다.
생화학 반응
기저시점에 ALT (IU/mL) 비정상 수치를 나타낸 244명 중 엔테카비어 치료 1년 후 243명만 ALT 데이터가 있었다. 정상화율(normalization rate)은 치료 1년차에 83.13%(202/243), 2년차 87.86%(123/140), 3년차 94.87%(37/39)이었다(표 1).
혈청학적 반응: HBeAg 소실
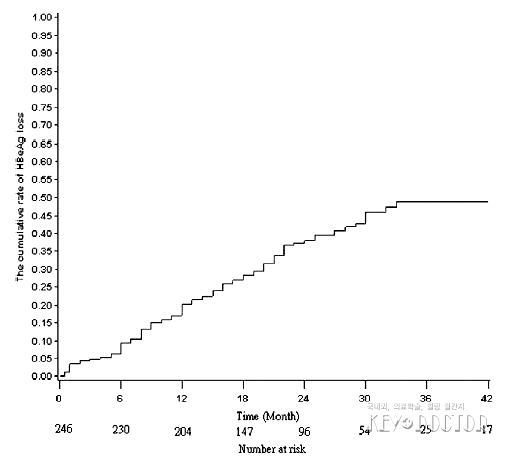
환자 248명 중 99명(39.9%)은 데이터 분석 시점에서 HBeAg 소실에 도달하였다. HBeAg 혈청전환율은 27.7%(64/231, 17건은 항HBe 항체 데이터 소실)이었다. HBeAg 소실 누적률은 치료 1년, 2년, 3년차에 각각 20.3%, 38.0%, 48.9%였다<표 1>. 게다가, Kaplan–Meier 법을 사용한 그림 1에서도 보여진다. 또한, ALT가 정상 상한치의 10배 초과인 경우 HBeAg 소실률은 55.2%(32/58)이었다.
콕스비례위험모델을 이용한 단변량 및 다변량 분석에서 HBeAg 소실과 관련된 인자
연령(>40세), 성별, 간경화 상태, 기저 HBV-DNA, 기저 ALT>5배 정상 상한치, 6개월 시점의 HBV-DNA를 조정한 후 단변량 및 다변량 분석 결과, 기저 ALT>5배 정상 상한치와 6개월 시점의 HBV-DNA는 엔테카비어 치료 환자에서 HBeAg 소실과 관계있는 독립적인 인자였다. 그러나, 성별, 연령, 간경화, 6개월 시점의 탐지불능 HBV-DNA는 HBeAg 소실과 무관하였다.
논의
치료경험이 없는 보상성 간질환을 동반한 HBeAg 양성 CHB 환자 248명에 대한 엔테카비어 real-world 연구에서 장기간 엔테카비어 치료는 우수한 생화학적 및 바이러스 반응에 도달할 수 있었다. 그러나, 혈청학적 반응은 보통이었다. 게다가, 기저시점의 ALT가 정상 상한치의 5배 이상이며, 기저 HBV-DNA가 낮은 것이 혈청학적 반응에 유리한 예측인자였다.
혈청 HBV-DNA는 간경화나 HCC로 진행하는 성인 HBV carrier의 장기 예후를 예측하였다. PEG-IFN 치료를 받은 HBeAg 양성 CHB 환자에서 기저 HBV-DNA가 낮을수록 HBeAg 소실률 또는 혈청전환율이 높았다. 게다가, 본 연구에서도 기전 HBV-DNA가 엔테카비어로 치료한 CHB 환자에서 혈청학적 반응을 예측할 수 있다는 것이 밝혀졌다. 초기 바이러스 반응은 항바이러스 치료 후 6개월에 HBV-DNA 탐지불능으로 정의하였는데, 초기 바이러스 반응이 있는 경우 항바이러스 연장 치료기간 동안 약물내성률은 낮았다. 게다가, 2년간 텔비부딘 치료 후 post-hoc 분석 결과 6개월차에 HBV-DNA 탐지불능은 치료 예후에 대한 강력한 예측인자였다. 본 연구에서 초기 바이러스 반응은 단변량 및 다변량 분석 결과 HBeAg 소실과 상관관계가 없었다. 그러므로, 엔테카비어 치료 6개월 후 HBV-DNA 탐지불능은 대만의 HBeAg 양성 CHB 환자에서 HBeAg 소실을 예측할 수 없었다. 이 결과는 텔비부딘 연구와는 일치하지 않았다.
ALT는 생물표지자(biomarker)로 바이러스에 감염된 간세포에 대한 숙주 면역 반응을 반영한다. 아시아 간염 라미부딘 연구에서, HBeAg 혈청전환율은 ALT가 정상 상한치의 5배 미만인 군보다 5배 이상인 군에서 유의하게 높았다. 게다가, 기저 ALT 수치는 라미부딘 치료시 HBeAg 혈청전환의 강력한 결정 요인으로 알려져 있다. 따라서, ALT가 항바이러스 치료 환자를 선택하는데 중요한 요소로 고려되어야 한다. 최근 연구에서도 엔테카비어 치료를 받는 CHB 환자에서 ALT가 정상 상한치의 5배 이상인 것이 HBsAg 혈청전환과 상관관계가 있다는 것이 밝혀졌다. 본 데이터에서도 기저 혈청 ALT가 정상 상한치의 5배 이상인 경우 엔테카비어 치료시에 우수한 혈청학적 반응과 양의 상관관계가 있었다. 이러한 증거들로 엔테카비어 치료시 혈청 ALT가 정상 상한치의 5배가 넘는 환자들은 HBsAg 및 HBeAg seroclearance 비율이 높았다. 게다가, 이 예측 인자는 엔테카비어와 라미부딘 모두에 적용할 수 있다.
이 연구는 몇가지 강점이 있다. 첫째, HBsAg seroclearance나 혈청전환이 치료 예후에 대한 이상적인 종말점이지만 아시아의 CHB 환자에게 있어서는 드물다. 치료시 HBeAg 소실 및/또는 혈청전환은 생화학 또는 바이러스 반응과 비교해 내구성이 높아 만족스러운 단기 치료 종말점으로 고려되고 있다. 이 연구의 대상 환자들은 대규모이며 모두 HBeAg 양성이었다. 둘째, 연구 환자들은 기존 연구의 환자들과 차이가 있었다. 기저시점의 혈청 ALT가 높고, 50% 이상은 정상 상한치의 5배를 넘었다. 그러므로, 치료 예후에 대한 혈청 ALT의 영향이 이 대상군에서 분명하게 설명될 수 있다. 셋째, 우리가 아는 한, 이 연구는 엔테카비어 치료를 받은 환자의 혈청학적 반응에 대한 유리한 예측인자를 확인하는 최초의 연구이다. 그러나, 본 연구는 몇 가지 한계점이 있다. 몇몇 환자에서는 기저시점 및 이후의 HBV-DNA 데이터를 사용할 수 없었다. 따라서, 바이러스 돌파율은 과소평가될 수 있다. 그러나, 누락된 HBV-DNA 데이터의 비율은 여전히 허용범위내이며, 1년차에 20.2%(50/248), 2년차에 12.1%(30/248)이었다. Real-world 데이터는 어떤 의도로 선택되는 것이 아니기 때문에 그 결과가 주요 결론들을 심각하게 훼손하지는 않는다. 또한, 이 연구에서는 4개의 서로 다른 HBV-DNA 측정법을 사용하였다. 국제 단위를 사용하여 연구실간의 바이어스를 최소화할 수 있었다. 게다가, 1차 치료 종말점은 바이러스 반응 대신 HBeAg 소실 및/또는 혈청전환을 사용하였다. 그러므로, 유리한 예측인자는 HBV-DNA 분석의 한계에 의해 영향을 받지는 않을 것이다. 게다가, 엔테카비어 내성의 돌연변이는 이번 후향적 연구에서 확인되지 않았고, HBsAg 소실 또는 혈청전환의 빈도는 사용할 수 없었다.
요약하면, 3년간 엔테카비어 장기 치료는 HBeAg 양성 CHB 환자에서 우수한 생화학 및 바이러스 반응을 달성할 수 있었다. 그러나, HBeAg 소실 및/또는 혈청전환면에서는 보통의 효과를 보였다. 또한, 기저시점에 ALT가 정상 상한치의 5배 이상이며 바이러스 부하가 낮은 HBeAg 양성 CHB 환자들은 엔테카비어 치료로 HBeAg 소실을 달성하기 매우 쉬웠다. 이러한 연구 결과는 HBeAg 양성 CHB 환자의 맞춤 치료를 설계하는데 유용할 것이다.
References
1. Kao JH, Chen DS. Global control of hepatitis B virus infection. Lancet Infect. Dis. 2002; 2: 395–403.
2. Chen DS. From hepatitis to hepatoma: lessons from type B viral hepatitis. Science 1993; 262: 369–70.
3. Zhang QQ, An X, Liu YH et al. Long-term nucleos(t)ide analogues therapy for adults with chronic hepatitis B reduces the risk of long-term complications: a meta-analysis. Virol. J. 2011; 8: 72–82.
4. Liaw YF. Impact of hepatitis B therapy on the long-term outcome of liver disease. Liver Int. 2011; 31 (Suppl. 1): 117–21.
5. Lai CL, Yuen MF. Chronic hepatitis B—new goals, new treatment. N. Engl. J. Med. 2008; 359: 2488–91.
6. Chang TT, Gish RG, de Man R et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N. Engl. J. Med. 2006; 354: 1001–10.
7. Lai CL, Shouval D, Lok AS et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N. Engl. J. Med. 2006; 354: 1011–20.
8. Gish RG, Lok AS, Chang TT et al. Entecavir therapy for up to 96 weeks in patients with HBeAg-positive chronic hepatitis B. Gastroenterology 2007; 133: 1437–44.
9. Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009; 50: 661–2.
10. European Association For The Study Of The Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis B. J. Hepatol. 2009; 50: 227–42.
11. Liaw YF, Kao JH, Piratvisuth T et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update. Hepatol. Int. 2012; 6: 531–61.
12. Yokosuka O, Takaguchi K, Fujioka S et al. Long-term use of entecavir in nucleoside-naive Japanese patients with chronic hepatitis B infection. J. Hepatol. 2010; 52: 791–9.
13. Yuen MF, Seto WK, Fung J, Wong DK, Yuen JC, Lai CL. Three years of continuous entecavir therapy in treatment-naive chronic hepatitis B Patients: VIRAL suppression, viral resistance, and clinical safety. Am. J. Gastroenterol. 2011; 106: 1264–71.
14. Chen CJ, Yang HI, Su J et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006; 295: 65–73.
15. Lau GK, Piratvisuth T, Luo KX et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N. Engl. J. Med. 2005; 352: 2682–95.
16. Liaw YF, Gane E, Leung N et al. 2-Year GLOBE trial results: telbivudine Is superior to lamivudine in patients with chronic hepatitis B. Gastroenterology 2009; 136: 486–95.
17. Lai CL, Gane E, Liaw YF et al. Telbivudine versus lamivudine in patients with chronic hepatitis B. N. Engl. J. Med. 2007; 357: 2576–88.
18. Zeuzem S, Gane E, Liaw YF et al. Baseline characteristics and early on-treatment response predict the outcomes of 2 years of telbivudine treatment of chronic hepatitis B. J. Hepatol. 2009; 51: 11–20.
19. Zoutendijk R, Reijnders JG, Brown A et al. Entecavir treatment for chronic hepatitis B: adaptation is not needed for the majority of naive patients with a partial virological response. Hepatology 2011; 54: 443–51.
20. Chien RN, Liaw YF, Atkins M. Pretherapy alanine transaminase level as a determinant for hepatitis B e antigen seroconversion during lamivudine therapy in patients with chronic hepatitis B. Asian Hepatitis Lamivudine Trial Group. Hepatology 1999; 30: 770–4.
21. Ridruejo E, Adrover R, Cocozzella D et al. Effectiveness of entecavir in chronic hepatitis B NUC-naive patients in routine clinical practice. Int. J. Clin. Pract. 2011; 65: 866–70.
